どのような病気?
リンチ症候群は、遺伝的にがんになりやすい体質の1つです。リンチ症候群で特に発症しやすいがんは、大腸がんと子宮内膜がんです。その他、脳腫瘍、胆道がん、胃がん、膵臓がん、小腸がん、皮膚腫瘍(皮脂腺腫など)、卵巣がん、腎盂・尿管がんも、一般集団に比べると発症しやすいとされています。こうしたがんが発症する時期やがん種は、人によって異なります。また、同時に複数のがんにかかったり、1つのがんが治った後に、他のがんや同じがんに再度かかったりすることもあります。しかし、リンチ症候群であれば必ずがんを発症するというわけではなく、生涯発症しない人もいます。
がんの発症しやすさと強く関わっている「遺伝要因」がはっきりとわかっているがんのことを「遺伝性のがん」といいます。がんが発症する要因は、大きく「遺伝要因」と「環境要因」に分けられます。遺伝要因とは、その人が生まれつき持っている遺伝子の特徴(変化)のことで、環境要因とは、年齢、紫外線、喫煙、飲酒、感染症など、生まれつきではない要因のことです。多くのがんは、環境要因の影響を大きく受けて、体の特定の組織で後天的に「体細胞変異」が起こり、これがきっかけで発生するがんです。これに対して遺伝性のがんは、生まれつき体の全ての細胞に、がんになりやすい特徴を持つ「生殖細胞系列の変異」があり、これが発症のきっかけとなるがんです。遺伝性のがんは、発症に関わる遺伝子によって、なりやすい部位や頻度などの異なるものが何種類か見つかっています。
リンチ症候群では、特定のがんの発症率が一般集団に比べて高いほか、次のような特徴も挙げられます。
- 50歳未満の若い年齢で発症する人が多い
- 大腸がんは多発性(1年未満に生じる「同時性」あるいは1年以上の「異時性」)
- 大腸がんは右側結腸に好発し、一般的な大腸がんより低分化腺がんの頻度が高い
リンチ症候群は、遺伝性大腸がんの中では最も頻度が高い疾患です。大腸癌研究会(JSCCR)編の「遺伝性大腸癌診療ガイドライン2020年版」によると、これまでの欧米の報告で、大腸がん全体のうち遺伝性大腸がんは5%、リンチ症候群は2~4%を占めると推定されています。日本遺伝性腫瘍学会のサイトに掲載の資料によると、日本人を対象に行われた研究では大腸がん全体の約100~180人に1人(0.6~1.0%)がリンチ症候群でした。また、英国の研究では一般集団(がんの人に限らない)の約140~650人に1人(0.2~0.7%)がリンチ症候群でした。日本人の一般集団における頻度は、今のところ不明です。
遺伝性大腸癌診療ガイドライン2020年版には、リンチ症候群における、各関連腫瘍の70歳までの累積発生率が以下のように示されています。
※がん種(累積発生率)
大腸がん(男性は54~74%、女性は30~52%)、子宮内膜がん(28~60%)、胃がん(5.8~13%)、卵巣がん(6.1~13.5%)、小腸がん(2.5~4.3%)、胆道がん(1.4~2.0%)、膵がん(0.4~3.7%)、腎盂・尿管がん(3.2~8.4%)、脳腫瘍(2.1~3.7%)、皮脂腺腫瘍(不明)
何の遺伝子が原因となるの?
リンチ症候群の原因として、MLH1遺伝子(染色体位置:3p22.2)、MSH2遺伝子(2p21-p16.3)、MSH6遺伝子(2p16.3)、PMS2遺伝子(7p22.1)、EPCAM遺伝子(2p21)の5つの遺伝子が見つかっています。これらの遺伝子に病的バリアント(がんの発症につながりやすいDNA配列の特徴)がある場合、リンチ症候群となります。
このうち、MLH1遺伝子、MSH2遺伝子、MSH6遺伝子、PMS2遺伝子の4つの遺伝子から作られるタンパク質は、いずれも、「ミスマッチ修復」という細胞分裂の際に重要な仕組みにおいて働いています。
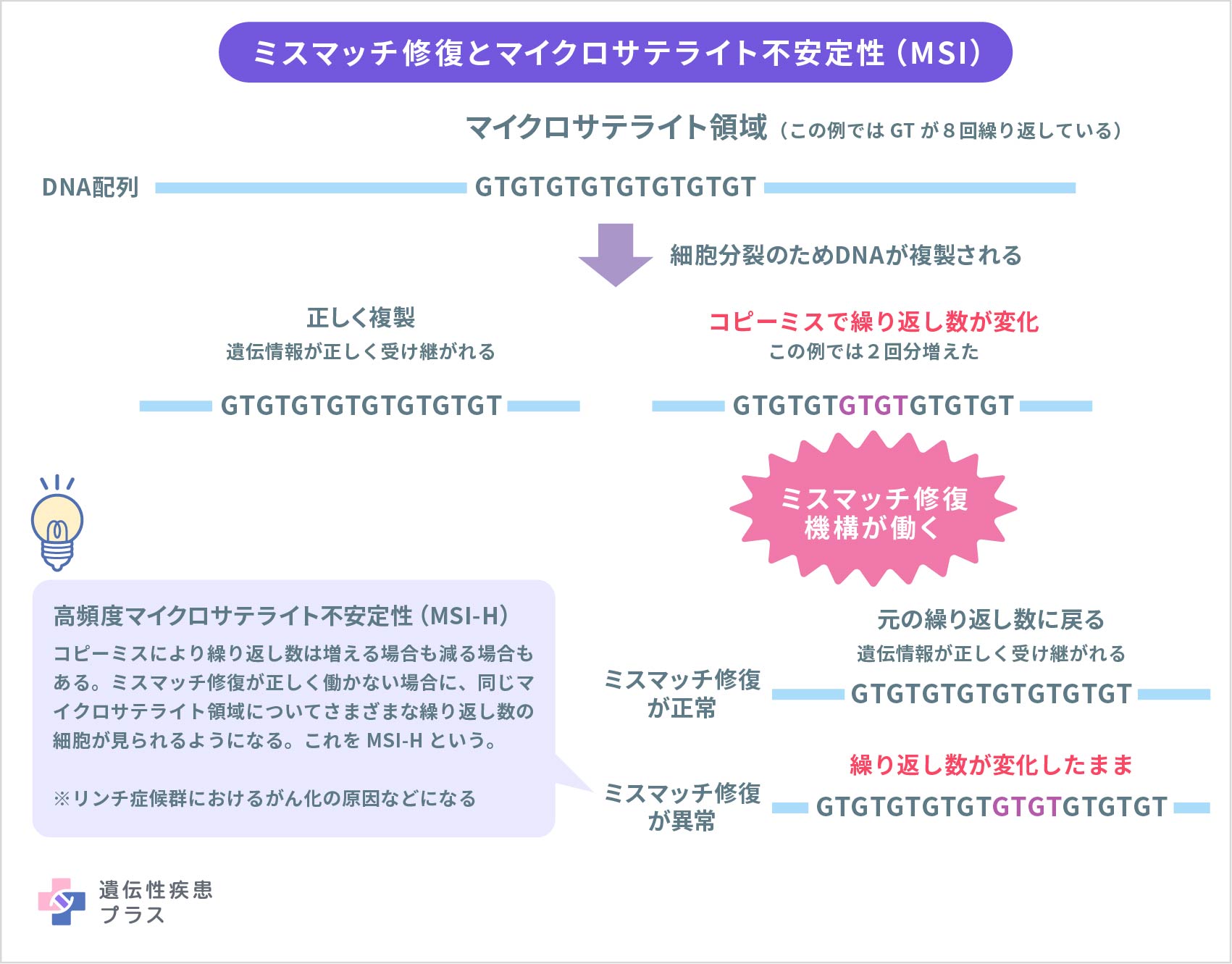
細胞が分裂するとき、分裂後の2つの細胞それぞれに同じ遺伝情報を分配するため、まず遺伝情報を保っている「DNA」全体が複製されます。この複製は、特定の酵素によって行われますが、ときどきDNAの塩基配列にコピーミスが起こります。コピーミスとは、例えば、ATGCという4つの塩基のうち、本来AとなるはずのところがGとなったり、DNA配列上に存在する「マイクロサテライト」(数塩基以内の短い塩基配列が何回も続いている部分)の連続回数が異なったりするなどのミスです。しかし、遺伝情報を次の細胞に正しく伝えるにはDNA配列を正確に複製する必要があるため、このコピーミスを見つけて修正する仕組みが細胞には備わっています。この修復機構を「ミスマッチ修復」といいます。ミスマッチ修復に関わるタンパク質は複数あり、それらのもととなるMLH1遺伝子、MSH2遺伝子、MSH6遺伝子、PMS2遺伝子のいずれかに病的バリアントがあると、リンチ症候群になります。ヒトは両親から1つずつ同じ遺伝子を受け継ぎ、2つ1セットでそれぞれの遺伝子を持っているのですが、リンチ症候群で生まれつき持つ病的バリアントは、2つある遺伝子のうちの片方です(専門的には「片方のアレルに生殖細胞系列の病的バリアントを有する」といいます)。片方の遺伝子からミスマッチ修復に関する正常なタンパク質がうまくつくられない状態で過ごしていくうちに、後天的にもう片方の、正しく働いていた方の遺伝子にも変異(あるいはプロモーター領域のメチル化と呼ばれる現象)が起こり、ミスマッチ修復が正しく働かなくなります。そうなった場合、細胞分裂を重ねることでコピーミスが蓄積され、がん化につながります。腫瘍抑制に関する遺伝子(TGFBR2など)、細胞増殖・DNA修復に関する遺伝子(MSH3、MSH6など)、アポトーシスと呼ばれる細胞死に関する遺伝子(BAXなど)などにはマイクロサテライトが含まれており、そうした部分にコピーミスが起きやすいことがわかっています。リンチ症候群のがん細胞では、90%以上で、コピーミスによりマイクロサテライトの連続回数が異なる細胞が増えています。この現象は「マイクロサテライト不安定性(MSI)」と呼ばれ、そうした細胞が増えている場合を高頻度マイクロサテライト不安定性(MSI-H、MSI-High)といいます。
EPCAM遺伝子は、ミスマッチ修復に直接関わる遺伝子ではありませんが、MSH2遺伝子の隣に位置しています。EPCAM遺伝子のうち、後半部分(3’側)が欠失した変異遺伝子から作られたタンパク質は、MSH2遺伝子の働きを抑えることがわかっています。専門的には、「MSH2遺伝子プロモーターの過剰メチル化」という現象を起こし、働きを抑えるのですが、なぜ抑えるのか、その理由はまだわかっていません。また、EPCAM遺伝子欠失のリンチ症候群では、MSH2遺伝子の病的バリアントをもつリンチ症候群よりも、子宮内膜がんのリスクが低いという報告があります。
遺伝性大腸癌診療ガイドライン2020年版には、リンチ症候群関連腫瘍の70歳までの原因遺伝子別累積発症リスクとして、下記が掲載されています。
| MLH1遺伝子 | MSH2遺伝子 | MSH6遺伝子 | PMS2遺伝子 | 一般集団 | |
|---|---|---|---|---|---|
| 大腸がん | 46~49% | 43~52% | 15~44% | 12~20% | 4.50% |
| 子宮内膜がん | 43~57% | 21~57% | 17~46% | 0~15% | 2.70% |
| 胃がん | 5~7% | 0.2~16% | 0~5% | - | <1% |
| 卵巣がん | 5~20% | 10~38% | 1~11% | - | 1.30% |
| 腎盂尿管がん | 0.2~5% | 2~18% | 0.7~7% | - | <1% |
リンチ症候群の原因として見つかっている5つの遺伝子の病的バリアントは、いずれも常染色体優性(顕性)遺伝形式で、親から子へ遺伝します。両親のどちらかがいずれかの原因遺伝子に病的バリアントをもっている(リンチ症候群である)場合、子どもが病的バリアントを受け継ぎ、リンチ症候群となる確率は50%です。なお、親がリンチ症候群で、子がリンチ症候群ではない場合、その子の子ども(孫)は世代をまたいでリンチ症候群になることはありません。
また、両親がリンチ症候群ではなくても、子どもがリンチ症候群となる場合もあります。卵子や精子が形成される際に偶然起きた遺伝子の変化が原因となる場合で、新生変異と呼ばれます。
参考として、リンチ症候群の原因遺伝子の一つであるMLH1遺伝子は、日本人の大腸がん全体の約6%で正しく働かなくなっています。その原因はMLH1遺伝子の変異ではなく、MLH1遺伝子に「高度メチル化」という化学変化が起きていることによります。これは、MSI-Hを示す散発性大腸がん(遺伝性ではなく後天的ながん)の主な原因となっています。
どのように診断されるの?
遺伝性大腸癌診療ガイドライン2020年版によると、家族歴を含め、リンチ症候群が疑われる人に対し、次のステップ1~3の流れで確定診断が行われます。
ステップ1(一次スクリーニング)
「アムステルダム基準Ⅱ」あるいは「改訂ベセスダガイドライン」を満たすかどうかの確認が行われます。
アムステルダム基準Ⅱ(1999)
少なくとも3人の血縁者が関連腫瘍(大腸がん、子宮内膜がん、腎盂・尿管がん、小腸がん)に罹患しており、以下のすべてを満たしている
- 罹患者の1人について他の2人は第1度近親者(子ども、きょうだい、親)である
- 少なくとも連続する2世代に罹患者がいる
- 少なくとも1人のがんは50歳未満で診断されている
- 腫瘍は病理学的にがんであることが確認されている
- 家族性大腸腺腫症(FAP)ではない
改訂ベセスダガイドライン(2004)
※以下の項目のいずれかを満たす大腸がんの患者さんには、腫瘍のマイクロサテライト不安定性(microsatellite instability:MSI)検査が推奨されます。
- 50歳未満で診断された大腸がん
- 年齢に関わらず、同時性あるいは異時性の大腸がんあるいはその他のリンチ症候群関連腫瘍(大腸がん、子宮内膜がん、胃がん、卵巣がん、膵がん、胆道がん、小腸がん、腎盂・尿管がん、脳腫瘍(通常はターコット症候群にみられる膠芽腫)、ムア・トレ症候群の皮脂腺腫や角化棘細胞腫)がある
- 60歳未満で診断されたMSI-Hの組織学的所見(腫瘍内リンパ球浸潤、クローン様リンパ球反応、粘液がん・印環細胞がん様分化、髄様増殖)を有する大腸がん
- 第1度近親者が1人以上リンチ症候群関連腫瘍に罹患しており、その関連腫瘍のうち1つは50歳未満で診断された大腸がん
- 年齢に関わりなく、第1度近親者あるいは第2度近親者(祖父母、叔父・叔母、おい・めい、孫)の2人以上がリンチ症候群関連腫瘍と診断されている患者さんの大腸がん
ステップ2(二次スクリーニング)
腫瘍組織をMSI検査で調べることで、高頻度MSI(high-frequency MSI:MSI-H)の確認が行われます。あるいは腫瘍組織の免疫組織学的検査(免疫染色)で原因遺伝子から作られるタンパク質を調べることで、ミスマッチ修復タンパク質の消失が確認されます。こうした検査の結果と、家族歴や既往歴などを総合的に考えることで、リンチ症候群である可能性がある程度推測されます。なお、2022年10月時点で、MSI検査は保険収載されており、免疫組織学的検査は保険収載されていません。
MSI-HまたはMLH1、PMS2の発現消失が確認された人のうち、腫瘍組織のBRAF V600E検査で変異型と判定、あるいはMLH1メチレーション検査でMLH1プロモーターメチル化陽性と判定された場合には、ほぼリンチ症候群ではないと判定され、ステップ3に進む必要はないとされています。ただし、PMS2遺伝子に病的バリアントがあるリンチ症候群の大腸がんの一部では、BRAF V600E遺伝子バリアントを認めることがあるという報告もあります。なお、2022年10月時点で、BRAF V600E検査は保険収載されており、MLH1メチレーション検査は保険収載されていません。
近年、欧米では、リンチ症候群の診断感度と費用対効果の高い方法として、全て(あるいは70歳以下)の大腸がんや子宮内膜がんに対し、ステップ1を経ず、ステップ2を行う「ユニバーサルスクリーニング」が推奨されています。高齢の大腸がん患者さんでは、リンチ症候群の患者さんが含まれる割合が相対的に低い一方で、散発性ミスマッチ修復異常大腸がんの頻度が高い傾向があるため、70歳未満など、年齢制限も提唱されています。
ステップ3
確定診断のために、血液などの正常組織を用いてMLH1、MSH2、MSH6、PMS2、EPCAM遺伝子に病的バリアント(変異)があるかどうかを、遺伝学的検査で調べます。病的バリアントを認めた場合、リンチ症候群と確定診断されます。この遺伝学的検査は、2022年10月時点で、保険収載されていません。
リンチ症候群の関連腫瘍が発症するのは、一般に成年期以降なので、遺伝学的検査の時期も原則的に成年期以降になります。遺伝学的検査は、結果の解釈など、とても専門的な検査です。わからないことや心配なこと、検査を受けるタイミングなどを含め、検査を受ける前から、担当の医師や認定遺伝カウンセラー(R)などと、よく話し合いましょう。
どのような治療が行われるの?
大腸がん
リンチ症候群における大腸がんは、多発する傾向があるため、手術の前には大腸全体の検査が行われます。また、大腸がんが見つかった場合、手術の前に関連腫瘍(特に婦人科がん、泌尿器がん、大腸癌以外の消化器がん)の検査も行っておく方が望ましいとされています。
大腸の切除範囲(術式)は、「散発性大腸がんと同等の切除範囲」「結腸全摘術」「大腸全摘術」の3つのうちから選択されます。
リンチ症候群の大腸がんに限定した場合の化学療法の有用性については明らかになっていませんが、リンチ症候群の大腸がんの大部分で見られるMSI-Hの特徴は、一般的に5-FU系抗がん薬の効果が認められないと報告されています。一方で、リンチ症候群では進行・再発大腸がんに対する免疫チェックポイント阻害剤の治療が強く推奨されています。
なお、リンチ症候群で大腸がんを未発症の人に対する予防的大腸切除は、有用性について専門家による一致した意見が得られていないため、一般的には推奨されていません。
その他、大腸がんの一般的な治療については、こちらをご参照ください。(遺伝性疾患プラスを運営するQLifeの、がん情報メディア「がんプラス」の記事に遷移します。)
大腸がん以外の関連腫瘍
大腸がん以外の関連腫瘍の治療は、通常のがん(散発性がん)と同様の治療が行われています。リンチ症候群における婦人科がんのリスク低減手術については、海外では推奨されていますが、日本においてはまだ有用性の検証が必要な状況で、推奨されていません。
子宮内膜がん(子宮体がん)など、それぞれのがんを発症した場合の一般的な治療については、「がんプラス」もぜひご参照ください。
関連腫瘍を早期発見・治療するための定期検査
リンチ症候群では、若い年齢でがんを発症しやすいため、がんや前がん病変(将来がんに進行する可能性がある、現時点では良性の腫瘍)を早期に発見するため、20~30歳代から定期的に検査(サーベイランス)を受け始めるように勧められています。
遺伝性大腸癌診療ガイドライン2020年版には、リンチ症候群の主な関連腫瘍に対するサーベイランスの目安として、下記が掲載されています。
| 部位 | 検査方法 | 検査開始年齢 | 検査間隔 | コメント |
|---|---|---|---|---|
| 大腸 | 大腸内視鏡検査(大腸カメラ) | 20~25歳 | 1~2年 | |
| 子宮・卵巣 | 経膣超音波検査、子宮内膜組織診 | 30~35歳 | 1年 | |
| 胃・十二指腸 | ヘリコバクター・ピロリ菌感染検査 | 30~35歳 | なし | 感染していたら除菌 |
| 胃・十二指腸 | 上部消化管内視鏡検査(胃カメラ) | 30~35歳 | 1~3年 | 胃がんリスクが高いと判断された場合、または胃・十二指腸がんの家族歴がある場合に考慮される |
| 尿路 | 検尿(または尿細胞診) | 30~35歳 | 1年 | MSH2バリアント、または尿路上皮がんの家族歴がある場合に考慮される |
こうした定期的な検査で、例えば大腸腺腫(将来大腸がんになる可能性があるポリープ)を発見した場合はポリープ摘除を行い大腸がんを未然に防ぐことができます。
また、この検査や間隔などは、あくまでも「目安」です。既往歴や家族歴、原因遺伝子などによってリスクは異なるため、定期検査のタイミングや方法は、主治医の先生とよく相談するようにしてください。
その他、日本遺伝性腫瘍学会の資料には、発がんの予防として、禁煙、適正体重の維持、ビタミンやカルシウム、果物の摂取、節酒などの生活習慣の改善が勧められると記載されています。
どこで検査や治療が受けられるの?
日本全国の「暫定遺伝性腫瘍指導医」とその所属医療機関は、一般社団法人日本遺伝性腫瘍学会ウェブサイトの「暫定遺伝性腫瘍指導医のリスト」からご確認頂けます。
患者会について
リンチ症候群の患者会・患者支援団体を、この欄でご紹介していきます。
掲載を希望される団体様は、こちらからご連絡をお願い致します。
参考サイト
- 一般社団法人 日本遺伝性腫瘍学会 リンチ症候群
- 大腸癌研究会編 遺伝性大腸癌診療ガイドライン 2020 年版
- 日本消化器病学会附置研究会 がんゲノム医療時代におけるLynch症候群研究会 Lynch 症候群について








