2023年8月30日、眼科領域の疾患に対する初めての遺伝子治療薬「ルクスターナ(R)注」(一般名:ボレチゲン ネパルボベク、以下「ルクスターナ」)が、保険適用の治療薬として国内で販売開始となりました(関連ニュースはコチラ)。ちょうどこの頃に、遺伝性疾患プラス3周年記念イベントとして行っていた「日本における遺伝子治療2023」でもルクスターナについての話題が上がり、世間的のみならず遺伝性疾患プラス読者の方々にとっても注目の治療であることが改めてわかりました。そこで今回、この遺伝子治療について、具体的にどのような方が治療の対象となるのか、治療によりどのような効果が期待できるのか、などの基本的なことから、現状での課題や将来展望まで、三重大学大学院医学系研究科 臨床医学系講座 眼科学教授で、日本網膜硝子体学会 ルクスターナ注 適正使用指針策定委員会に所属しておられる、近藤峰生先生に詳しくお話を伺いました。

「遺伝性網膜ジストロフィー」と遺伝子治療薬「ルクスターナ」について
治療の対象となる「両アレル性RPE65遺伝子変異による遺伝性網膜ジストロフィー」とはどのような疾患ですか?
遺伝性網膜ジストロフィー(IRD)は、遺伝的な原因によって網膜に異常を来す病気の総称です。IRDには、遺伝形式や原因遺伝子が異なるいろいろな病名のものが含まれますが、その中で、両アレル性RPE65遺伝子変異によるIRDは、病名としては「レーバー先天盲」に属する場合が多いです。このほか「早期発症型の網膜色素変性症」と診断されている人の中に、このタイプの遺伝子変異を持つ人がいる場合もあります。この疾患の特徴として、大きく次の3つが挙げられます。
- 生まれつき/幼少から非常に強い夜盲(暗いところではほとんど目が見えない)である
- 生まれつき/幼少から視力も非常に弱い
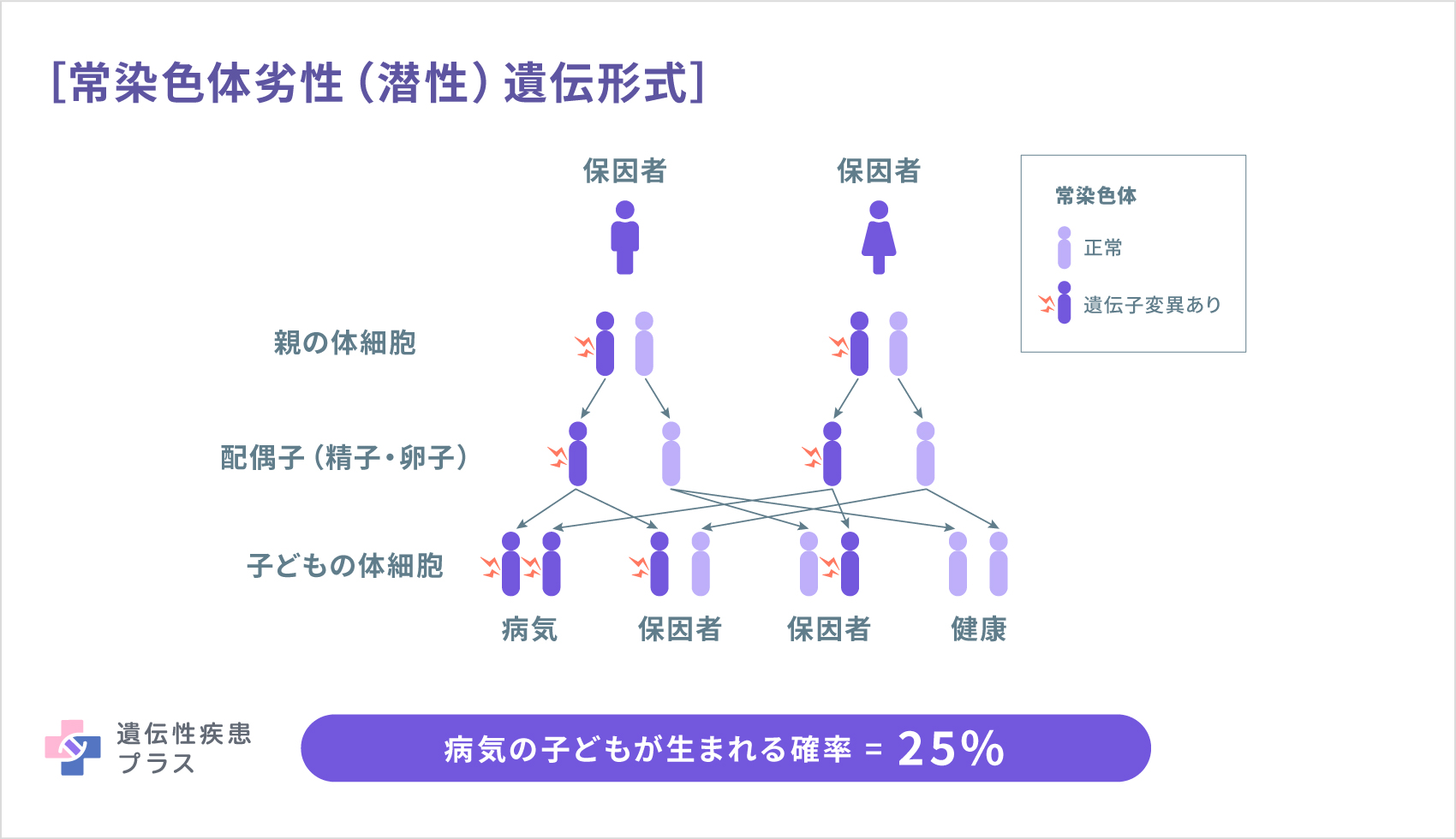
- 常染色体劣性(潜性)遺伝形式である
3つ目の特徴から、多くの場合、家系内に同じ病気の人は見られません。人間が2本1セットで持っているRPE65遺伝子のうち、両親がともに1本ずつに変異を持っており、たまたまお子さんが両親から変異を持つ遺伝子をそれぞれ受け継いで2本とも変異遺伝子となった場合に発症されている場合が多いです。1本だけに変異があっても、このタイプのIRDを発症することはないため、通常、ご両親があらかじめ気づくことはありません。また、ご両親から変異遺伝子を2本とも受け継ぐ可能性は、確率的には4分の1です。
この他の特徴として、多くの患者さんで眼振(目が揺れるような症状)が見られることも挙げられます。生活上の特徴としては、小さい頃から目が不自由なので、盲学校に通っていたり、小学校で視覚支援を受けていたりしている場合がほとんどです。
RPE65というのはどのような役割をする遺伝子ですか?
目の奥で、光を感じるフィルムの役割を果たしている部分を「網膜」と言いますが、網膜の中には物を見るための「視細胞」があり、これを下から網膜色素上皮細胞が支えています。
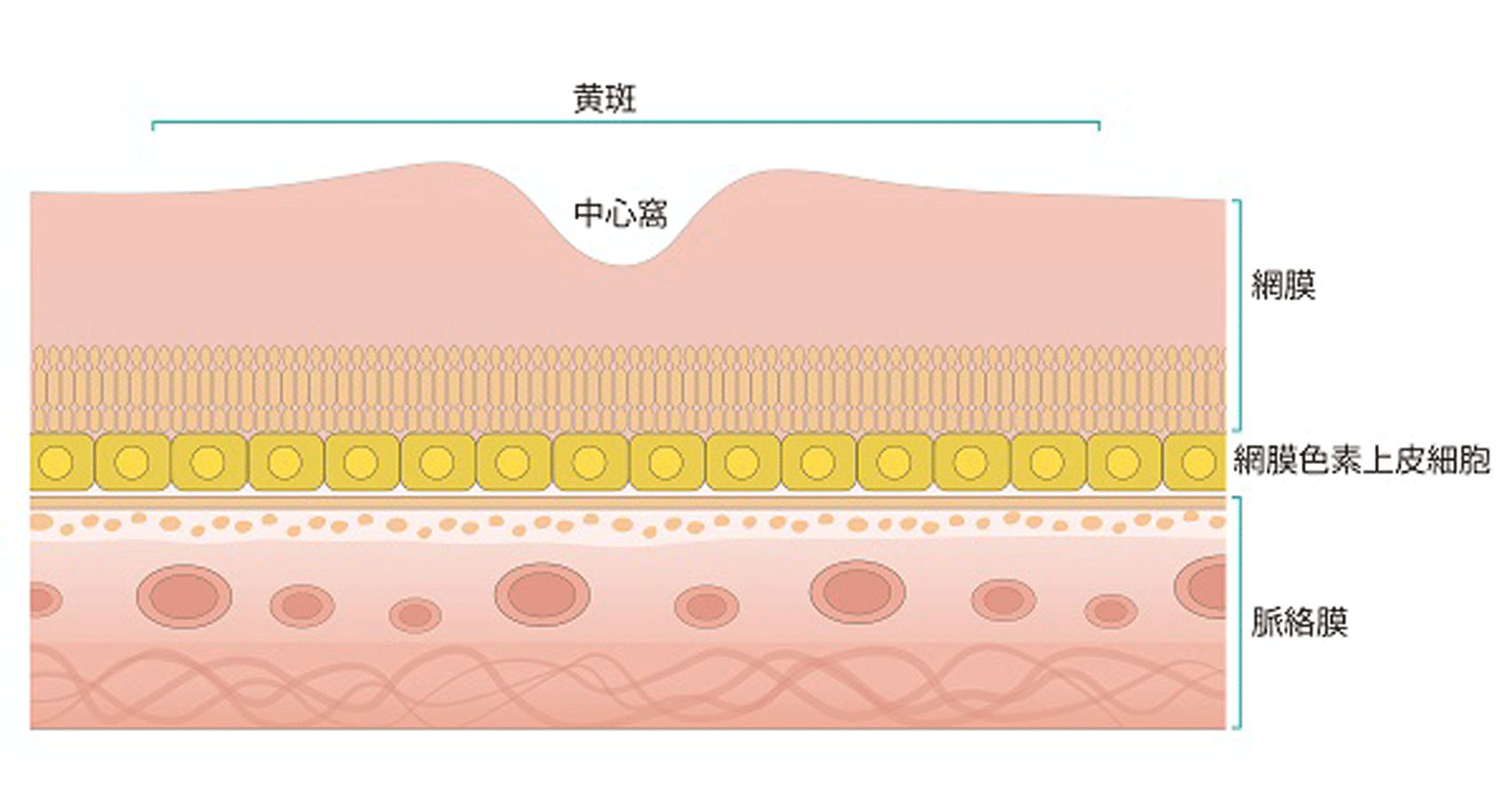
網膜色素上皮細胞は、視細胞が物を見る機能に必須の「ビタミンA」を供給するために重要な役割を果たしています。視細胞と網膜色素上皮細胞の間では、「ビタミンAサイクル(レチノイドサイクル)」と呼ばれる代謝回路が動いており、ここで作られたビタミンAが視細胞に与えられているのです。この、ビタミンAサイクルで働く分子のうちの1つが、網膜色素上皮細胞が作るRPE65タンパク質で、その設計図となるのがRPE65遺伝子です。
RPE65遺伝子の変異により、RPE65タンパク質が正しく機能しなくなると、ビタミンAサイクルが正しく動かなくなり、網膜色素上皮細胞から視細胞にビタミンAを供給することができなくなります。すると視細胞は、生きているものの、ビタミンAが供給されないために、光や物を見る機能が著しく低下した状態になります。そこで、RPE65遺伝子変異のある網膜色素上皮細胞に、遺伝子治療で正常なRPE65遺伝子を導入すると、ビタミンAサイクルが再び動くようになり、視細胞の機能が復活します。ちょうど、電池切れで止まっていた時計に、新しい電池を入れると再び動き出すようなイメージですね。
IRDの原因遺伝子がたくさんある中で、なぜRPE65遺伝子が今回治療の対象として選ばれたのでしょうか?
理由の一つは、今お話ししたように、網膜の細胞が電池切れのような状態になっているだけで、遺伝子を補えば再び視細胞の機能回復が期待できるからです。網膜ジストロフィーの多くは視細胞の障害が進行しており、遺伝子治療で正常な遺伝子を導入しても機能の回復が期待できません。その中で、RPE65遺伝子変異によるIRDは、健常な視細胞が残っている患者さんがいるため、治療の対象となりました。
もう一つの理由として、RPE65遺伝子は比較的サイズが小さい遺伝子であるため、遺伝子治療薬の設計が行いやすかったことも挙げられます。ルクスターナは、「AAVベクター」と呼ばれる遺伝子の運び屋に、正常なRPE65遺伝子を搭載して網膜色素上皮細胞に届けるのですが、AAVベクターは搭載できる遺伝子の大きさが比較的小さなものに限られています。その大きさ制限においてRPE65遺伝子は問題がなかった分、設計がスムーズに進みました。
それから、遺伝子変異によるIRDは、検証のための動物モデルが確立されているものが少ない中で、RPE65遺伝子変異によるIRDは、同じ変異を有するイヌのモデルが確立されていたところも、大きな理由です。動物実験の段階で、RPE65遺伝子変異を有するイヌにこの遺伝子治療を行ったところ、高い効果が確認されたことで、臨床応用への開発が進みました。イヌだったというところもポイントで、目が見えず、暗いところであちこちにぶつかりながら飼い主のもとへたどり着いていたイヌが、遺伝子治療後にスタスタと飼い主に向かって歩いて行かれるようになったことから、「確かに見えている」という確認もできたわけです。
この遺伝子治療の適応になる人は、日本にどれくらいいるのでしょうか?
両アレル性RPE65遺伝子変異によるIRD患者さんの人数は非常に少なく、日本に20~50人ほどいると推定されていますが、この遺伝子治療の適応となる患者さんは、その中でも絞られることとなります。というのは、健常な網膜細胞に正常遺伝子を導入することで効果が得られる治療であるため、「健常な網膜の面積が十分生き残っている」という条件が必須となるからです。両アレル性RPE65遺伝子変異によるIRD患者さんのうち、網膜が非常に強く変性している人(多くの場合高齢者)は適応にならず、若い患者さん、健常な網膜部分が残っている患者さん、が適応になります。
この遺伝子治療には、年齢制限はありますか?
年齢制限は特にありません。両アレル性RPE65遺伝子変異によるIRDは、変異の起きている場所などによって発症年齢や重症度が人によって異なる場合があり、比較的高齢の患者さんでも、十分な生存網膜細胞が確認できれば、治療の対象となり得ます。一方で、これまでに海外で行われた治験の結果を見ると、年齢が若い患者さんの方が、良好な効果が得られているようです。徐々に進行し、健常な視細胞が減って来るためと考えていますが、年齢制限は設けられていないので、検査で適応となったら、この遺伝子治療を行っている病院に受診して頂くことになると思います。
日本の臨床試験では、4歳以上の方を対象に治療の効果を評価しましたが、4歳以上でなくてはいけないという制限も基本的にはありません。ただ、見え方の測定をするときに、泣かずに、見える/見えないの正しい判断ができるのが4歳以上であるということと、4歳未満では海外でも治療実績が少ないので、予期しない合併症や問題が起きる可能性が捨て切れないというところは留意点です。これまでの治療実績では、4歳以降の治療で遅すぎるということはなく、しっかりと効果が示されているため、必ずしも低年齢の赤ちゃんで治療を開始する必要はないと考えられています。
治療は「網膜下の単回投与」で行われるとのことですが、両目にそれぞれ1回ずつ注射をするのですか?
はいそうです。この遺伝子治療の適応となる患者さんは、両目に同じような見づらさを感じている方がほとんどですので、片目には生きている網膜細胞がほとんど確認されないとか、事故で片目を完全に失っているなどでなければ、基本的には両目に1回ずつ、6~18日程度の間隔を置いて注射して治療をします。1回目と2回目の間隔は、あまり長くはあけません。その理由は、遺伝子の運び屋として用いているAAVベクターに対する免疫応答が体内で起こってきて、2番目の治療の効果が薄れる可能性があるからです。
この治療を受けるために、入院は必要でしょうか?
注射して行う治療とは言え、決して簡単な治療ではなく、日帰りでは難しいため、入院して頂きます。全身麻酔をしたうえで、熟練した医師が網膜色素上皮細胞にRPE65遺伝子を運ぶ薬液を、顕微鏡を見ながら注入するという微細な手術になります。国内でこの遺伝子治療を行う施設は、現時点では東京医療センターと神戸アイセンターの2か所と決まっており、いずれも入院期間についての決まりは設けていませんが、遺伝子治療薬の準備~投与、合併症が起きないかなどの経過観察を含め、およそ1~2週間程度の入院になると考えています。
この遺伝子治療を受けることで、どのような治療効果が得られるのですか?
先ほど、この病気の主な症状として、非常に強い夜盲があるとお話ししましたが、遺伝子治療によりそれが改善します。これまで暗くなると周りが全く見えなかった人が、治療後は夕方や夜道でもこれまでよりずっと楽に外を歩けるようになる、といったイメージを持って頂ければと思います。
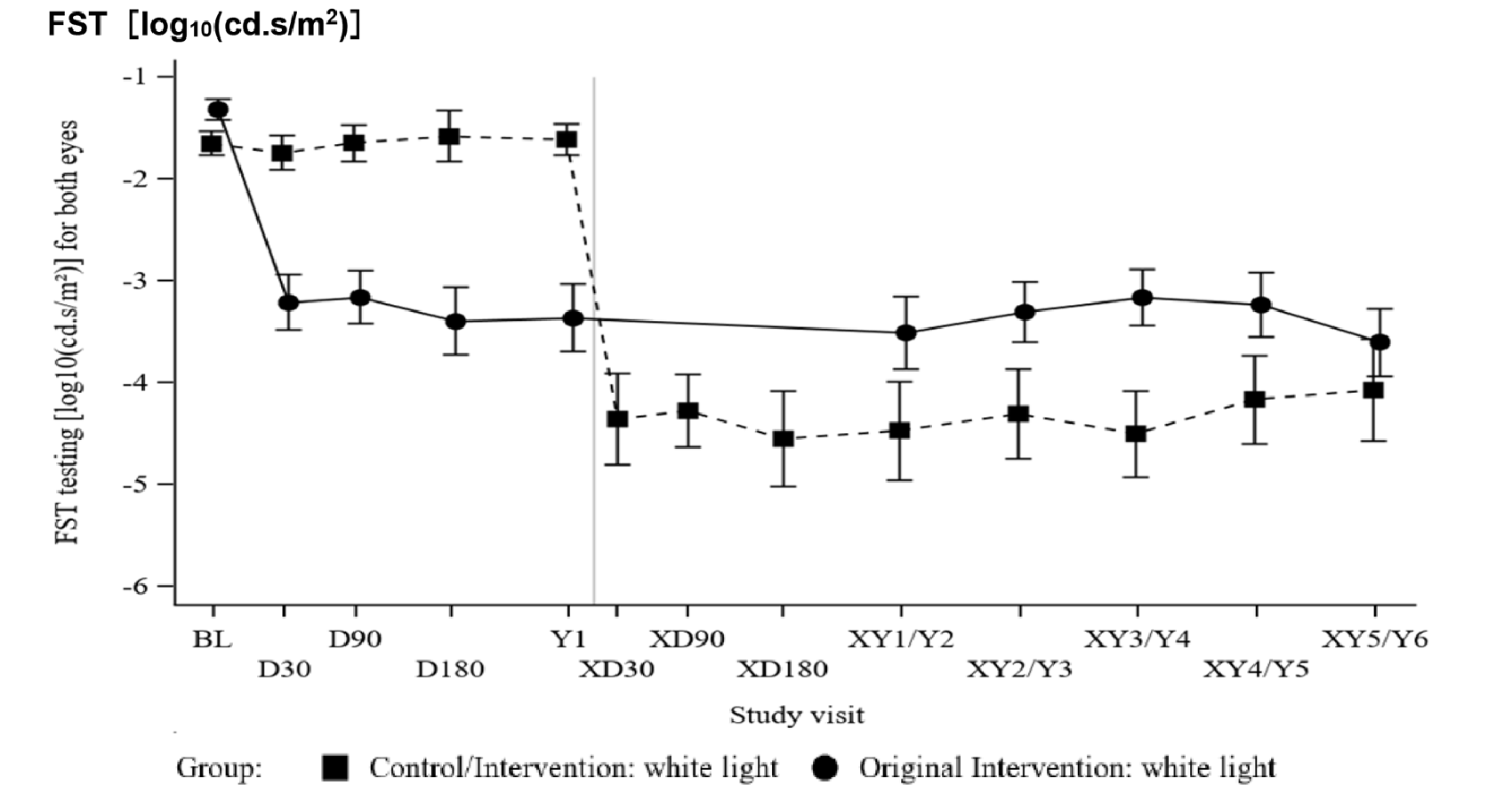
下の図は、日本網膜硝子体学会が2023年7月11日に発行した、「ルクスターナ注 適正使用指針」に載っている、海外での治験結果です。縦軸の「FST」は、暗いところでどれくらい見えるかという閾値の検査値で、数値が大きい(上に行く)ほど、見えるのに強い光が必要であることを示します。まずは、実線+黒丸のグラフを見てください。治療前(横軸でBL)での数値は「-1」付近であったのが、治療30日後(横軸でD30)には「-3」付近になっています。この数値は、1変化すると10倍光の強さが変化することを示すため、この結果は、「治療後わずか1か月程度で、これまでより100倍弱い光まで暗闇で感知ようになり、その効果が少なくとも6年(Y6)続いている」ことを示しています。もう一つの、破線+四角のグラフの方は、最初は治療群でなく対照群に割り振られていた人が、後から有効な遺伝治療薬の投与を受けた場合の結果で、治療30日後(横軸でXD30)には、やはり100倍以上弱い光が感知できるようになり、その効果が長期間継続することが示されています。
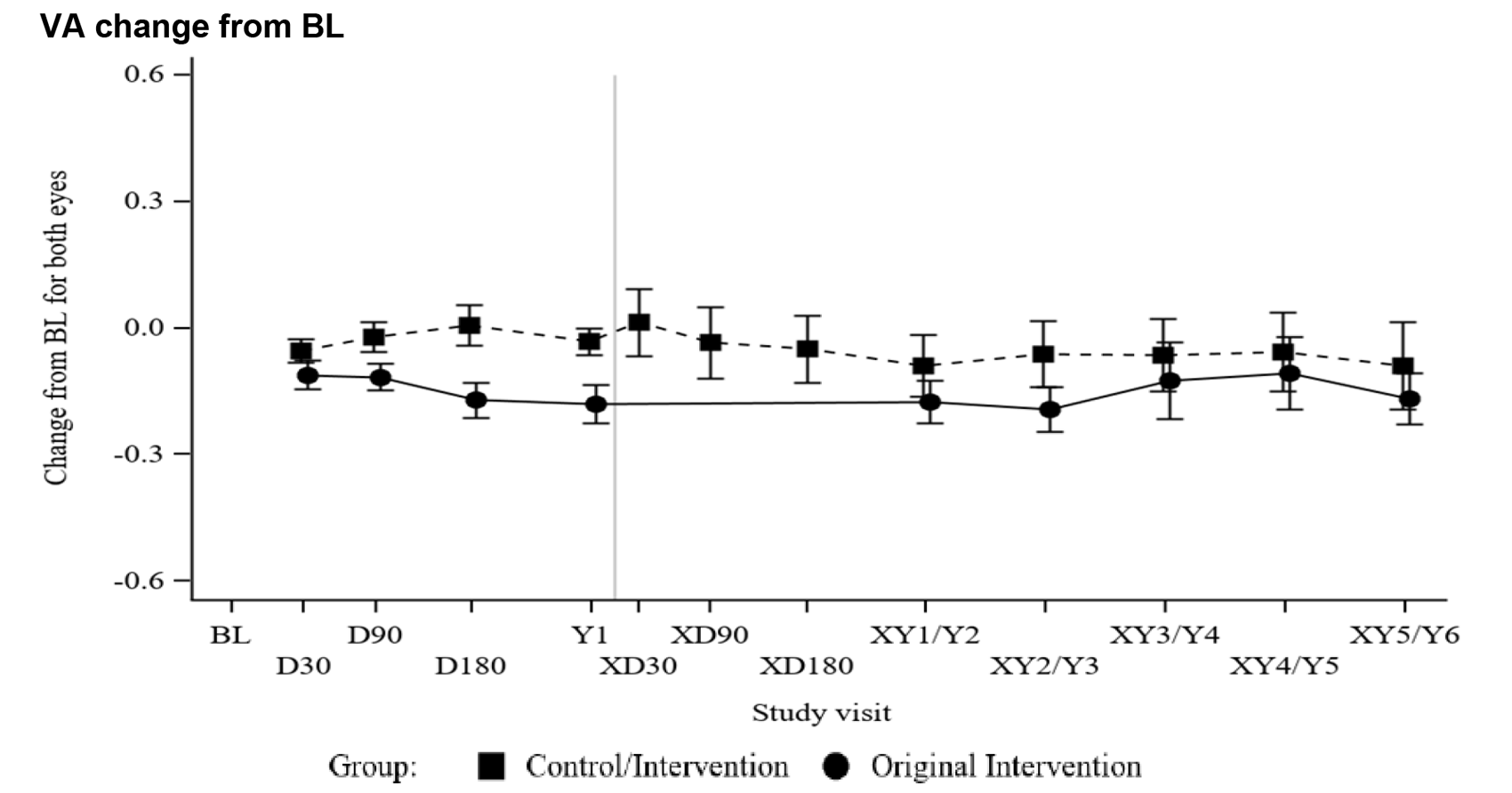
一方で、視力については、この遺伝子治療により大きな改善は見られませんでした。下の図で、縦軸が視力を表す数値、横軸が治療後の経過時間となりますが、上下に大きな変化が見られていないことがわかります。
適正使用指針には、日本人を対象に行われた治験の結果も載っており、海外と同様に、治療により100倍弱い光が見えるようになることが示されています。比較的若い患者さんの方が、30日後などの早期から改善が見られ、年齢の高い患者さんでは、1年くらいかけて徐々に改善する傾向が見られました。日本人の場合でも、視力の改善については見られませんでした。
まとめると、ルクスターナによる治療を受けた後、ほとんどの方は、視力は改善せず矯正視力が0.1以下のままですが、暗いところで光を感知する力が100倍くらい改善し、暗くても周りが見やすく歩きやすくなる、といった効果が得られます。個人差はありますが、この改善は早ければ治療1か月後の検査で明らかになります。普段の生活では、例えば、これまでは薄暗い場所や、映画館で急に暗い部屋に入ったときなどに全く見えなくなっていた状況が、どこに障害物があるのかなど、見えて気付けるようになることが期待されます。
起こり得る副作用やその頻度なども教えてください
副作用は、どちらかというと手術手技に関するものが多い傾向にあります。網膜を膨らませて薬液を注入するため、網膜剥離や、目の中の出血・炎症などが副作用として起こることがあります。手術により水晶体が濁る白内障が起こる場合もあります。ただし、こういった副作用はどれも、薬でコントロールができたり、追加の手術で治せたりする場合がほとんどです。
治療後の経過観察はどの程度の間隔で行われますか?
退院後しばらくは、副作用なども心配なので、1か月~半年間隔で経過観察をすることになります。その後は、1年に1回くらいの間隔で経過観察をして、目の奥に合併症が起きていないか調べたり、見え方の検査を行ったりしていくことになります。厚生労働省からの定めにより、経過観察は、5~10年と長期間に渡り行われることになります。
この遺伝子治療の適応となる患者さんはそれほど多くないため、日本では治療を実施する施設は現在は東京医療センターと神戸アイセンターの2か所だけと決めていますが、患者さんは北海道や沖縄にお住いの場合もあると思いますし、経過観察のために遠方から10年間これらの病院に通い続けるのが大変な場合もあると思います。しかし私たちとしては、どんなに遠くても、年に1回は治療を受けた病院へ経過観察のために通い続けて頂きたいと思っています。
治療後に使い続ける薬などはありますか?
手術の後は、感染症を起こさないための抗生物質の点眼や、炎症を起こさないためのステロイドの内服をしてもらいます。これらの薬は、1~3か月間使用してもらうことになりますが、その後は合併症が起こらない限り、使わなくて良くなります。
治療後の日常生活で避けた方が良いことはありますか?
手術の後、傷口や網膜の具合が安定するまでの1~2か月は激しい運動は避けて頂きます。その後状態が落ち着けば、以前と同じように生活して頂いて問題ありません。プールにも入れますし、テレビもパソコンもOKで、見てはいけないものもありません。そういう意味では、患者さんにとって負担の少ない治療と言えるのではないかと思っています。
IRD遺伝子治療の現状と課題・将来展望
これまで日本で何人くらいがこの遺伝子治療を受けましたか?
ルクスターナが日本で販売開始となったのは2023年8月30日で、2023年12月現在、まだ一例も治療は実施されていません。今は、治療開始の準備をしている段階で、これまでに、治療の対象になる人を調べる遺伝子検査との連携や、治療に際しての細かなルール決めなどをしてきました。
RPE65遺伝子に変異があるかを調べる検査も保険適用で行うべきだという厚生労働省の方針に従って、シスメックス社がIRDの遺伝子パネル検査を立ちあげ、ルクスターナと同日(2023年8月30日)に販売開始となりました。この検査を国内で実施する施設として、10施設程度が間もなく決定します。生まれつき非常に見えにくい、暗いところが見えない、という患者さんがいたら、全国の10か所程度のいずれかの施設に来て頂き、遺伝子検査をして頂くという流れを作っています。今のところ、この検査を受ける候補となり得る患者さんは、全国に10人くらい待っていらっしゃると聞いています。年が明けて2024年には、最初の患者さんに治療が開始されると思います。
海外でこの遺伝子治療を受けた患者さんは、実際にどのように感じているのでしょうか?
暗いところで物が見えるようになるけれど視力の改善は見られない、この遺伝子治療に莫大な医療費がかかるわけですが、「これで患者さんは満足するのですか?」という質問をよく受けます。
しかし、今までは、ちょっと暗かっただけでも全く見えないため夕方になると外を歩くことを諦め、さらに治療法がなく進行するだけと言われていた人が、1回の治療で、暗くても見えるようになり、さらにその効果はずっと続きます。欧米では、小学生など小さなお子さんを中心に、既に多くの方にこの遺伝子治療が実施されていますが、実際に治療を受けた方々のインタビューを見ると、「世界が変わった」「人生が変わった」という声が聞かれています。

IRDの遺伝子治療について先生が現在感じている課題点があれば教えてください
この治療自体は、海外では10年以上の治療実績があり、非常に良い効果が得られることがわかっています。また、1回の注射で10年以上効果が続くことが示されおり、今のところは長期間効果が続くと信じられています。ただ、20年後、30年後と、さらに先の経過については、まだわかっていません。これが課題の一つです。
もう一つの重要な課題は、両目で約1億円の費用がかかる、とても高価な治療であるという点です。保険医療として1億円の治療を行うというのは、日本人全員が、治療を受ける患者さんのために1円ずつ出していることを意味します。これは大変なことですよね。今回、日本でこの遺伝子治療の適応となる人は15人~20人程度と考えられていることも踏まえ、厚生労働省はこの高額な治療を保険承認しました。一方で、同じように遺伝子の異常で起こる網膜の病気はたくさんあり、その中で遺伝子治療により改善する可能性のあるものが、研究によって次々とわかってきています。海外で、既に治験が始まっているものもあります。それらの開発が進んだときに、次々と同じように高額な医療費を保険医療としてかけられるか、というのは大きな課題です。今後、技術開発によるコストダウンや、異なる発想での低コストな治療法などの登場が望まれます。
そうすると、今後RPE65遺伝子以外に原因があるIRDに対して、日本で遺伝子治療が展開されていく見込みはあるのでしょうか?
今回、RPE65遺伝子のみではなく、82個の原因遺伝子を搭載したIRDの遺伝子パネル検査を厚生労働省が承認した理由には、日本に患者さんがいることがわかっている遺伝性の網膜疾患の原因の多くが、この82個の遺伝子で網羅されている、というところにあります。今のところ、この遺伝子パネル検査の重要な役割は、RPE65遺伝子に変異がありルクスターナによる治療の対象となるかを確かめることであり、まだ、それ以外の遺伝子治療の対象になるかを確かめる目的で行われるものではありません。そのため、今のところ、この遺伝子パネル検査を保険適用で受けられるのはRPE65遺伝子異常が疑われる人だけで、どのようなIRDの人でも保険適用でこの検査が受けられるというわけではないのです。実際に、RPE65遺伝子が原因であることを確かめるために検査をしたら、別の遺伝子だったということもあり、治療前にこの遺伝子パネル検査でしっかり鑑別ができることは大変重要です。
一方で、82個の遺伝子の中のいくつかは、既に海外で臨床試験が進んでいます。ですので、この検査により、RPE65遺伝子に変異が見つからなかった場合も、今後遺伝子治療が可能になりそうな疾患であるかどうかがわかるようになります。先ほどお話ししたような医療費の課題はあるものの、将来的に、他の原因遺伝子に対する遺伝子治療も出てきたら、この検査を保険適用で受けられる人の範囲も広がっていくのだと思っています。そのためにわざわざ82個もの遺伝子を載せているのでしょう。
自分がルクスターナによる治療の対象になるのかはどうしたらわかるのでしょうか?
先ほどもご説明しましたが、「物心ついた頃から暗いところが見えづらく視力もかなり悪い、そのために学校生活や社会生活に支障をきたしている」という方は、まずは一度眼科を受診して、レーバー先天盲の可能性はありませんかと尋ねてみるのが良いと思います。可能性があると診断された場合、IRDの遺伝子パネル検査を行う全国10か所程度の施設のいずれかを受診して検査を受けて頂き、その結果、RPE65遺伝子変異が原因とわかった場合、東京医療センターか神戸アイセンター(遺伝子治療を行う2つの医療施設)のどちらかを受診して頂き、健常な網膜細胞が残っているかどうかを含め、ルクスターナによる治療の適応になるかどうかの検査を受けて頂く、という流れになります。ただし、最終的に治療の適応になる方は、それほど多くないということは知っておいて頂ければと思います。
最後に先生から遺伝性疾患プラスの読者に一言メッセージをお願いします
IRDという難病は、これまでは治療法がなく、眼科へ受診しても、検査を受け進行を見守ることしかできないような疾患でした。今回、非常に希少な遺伝子変異が原因となるIRDの一つについて、遺伝子治療が日本に導入され、効果が示され、保険適用になりました。この一歩は、IRD全体を考えるととても小さな一歩ですが、大きな希望だと私たちは考えています。これを足掛かりに、患者さんにとって有効な、新たな遺伝子治療、細胞療法、薬物療法などが開発されていくでしょう。また、既に開発が進んでいる新しい治療については順次承認に向けて臨床試験が行われていくでしょう。こうして少しずつ、原因の異なるいろいろな病気の患者さんに対し、進行を防げたり、改善したりできる新しい治療は増えていきます。今後、こうした治療を受けて良くなった患者さんの顔をたくさん見られるように、私たちも、これからも努力していきたいと思いますので、皆さんも希望を持って待っていて頂ければと思っています。
遺伝性の目の疾患に対する初の遺伝子治療、ルクスターナ。2023年8月の承認後、検査や治療のルールなどの準備が着々と整えられ、2024年には国内でいよいよ医療として治療が開始するといいます。治療の適応となる患者さんが少ないことや、医療費の課題などもあるものの、RPE65以外の遺伝子変異によるIRDを対象とした遺伝子治療や細胞治療の臨床試験も世界では始まっており、日本でも今回の遺伝子治療を皮切りに、今後治療できる疾患が増えていくことが期待されます。
近藤先生は、優しく穏やかな口調で、いろいろな資料を用いて、わかりやすく説明をしてくださいました。網膜の中に注射をする治療とはどのようなものなのか、動画を見せてくださったことが最も印象的で、鮮明に理解できたとともに、その微細さに驚きました。(近藤先生、ありがとうございました!)諸準備が整い、今まさに最初の治療が開始するところだということで、遺伝性疾患プラスでは、今後も遺伝性の目の疾患やその治療に関する最新ニュースを、随時皆さんにお届けしていきたいと思います。(遺伝性疾患プラス編集部)







