私たちの体を構成する細胞一つ一つが生きていく中で、生じた不要物はそれぞれの細胞内にある「ライソゾーム」で分解されています。ライソゾームの中には、さまざまな不要物を分解するためのたくさんの種類の酵素が含まれています。遺伝的な要因で、そうした酵素がうまく働かなくなると、不要物が蓄積することで細胞に不具合が生じ、病気の症状が引き起こされます。これが、ライソゾーム病です。
ライソゾーム病は、これらの酵素が関わるさまざまな病気の総称で、幼少の頃から発症するものも多く、一昔前には効果的な治療法がありませんでした。しかし、近年、いくつかのライソゾーム病に対する治療薬が登場してきており、ライソゾーム病は治療可能な病気になりつつあります。このように、今まさにパラダイムシフトが起こっているライソゾーム病の治療について、小児の先天代謝異常症などをご専門として日々診療を行っておられる、秋田大学大学院医学系研究科小児科学講座教授の高橋勉先生にお話を伺いました。

秋田大学大学院医学系研究科小児科学講座教授 高橋勉先生
ライソゾーム病とはどのような病気ですか?
人間の体は、さまざまな種類の、非常に多くの細胞で構成されています。そうした細胞の中には、遺伝情報を格納している核のほか、細胞質と呼ばれる部分があり、そこには、エネルギー源を取り出すミトコンドリアや、タンパク質の合成を手伝うリボソームなど、それぞれの役割を担う「細胞内小器官」が含まれています。そうした細胞内小器官の一つとして、細胞内の不要物を分解する役割を担っているのが「ライソゾーム」です。ライソゾームは膜に覆われていて、その内側は酸性(pH5くらい)になっています。細胞の中は通常、中性~弱アルカリ性(pH7.2くらい)なので、ライソゾームの中は特殊な環境と言えます。その特殊な環境に、50種類くらいのライソゾーム酵素が存在し、不要物を分解するために働いています。これらの酵素はすべて、酸性の環境下でのみ働く酵素(酸性加水分解酵素)であるため、酵素がライソゾームから外に漏れ出して、周囲の大事な物質をやみくもに分解するようなことは無い仕組みになっています。
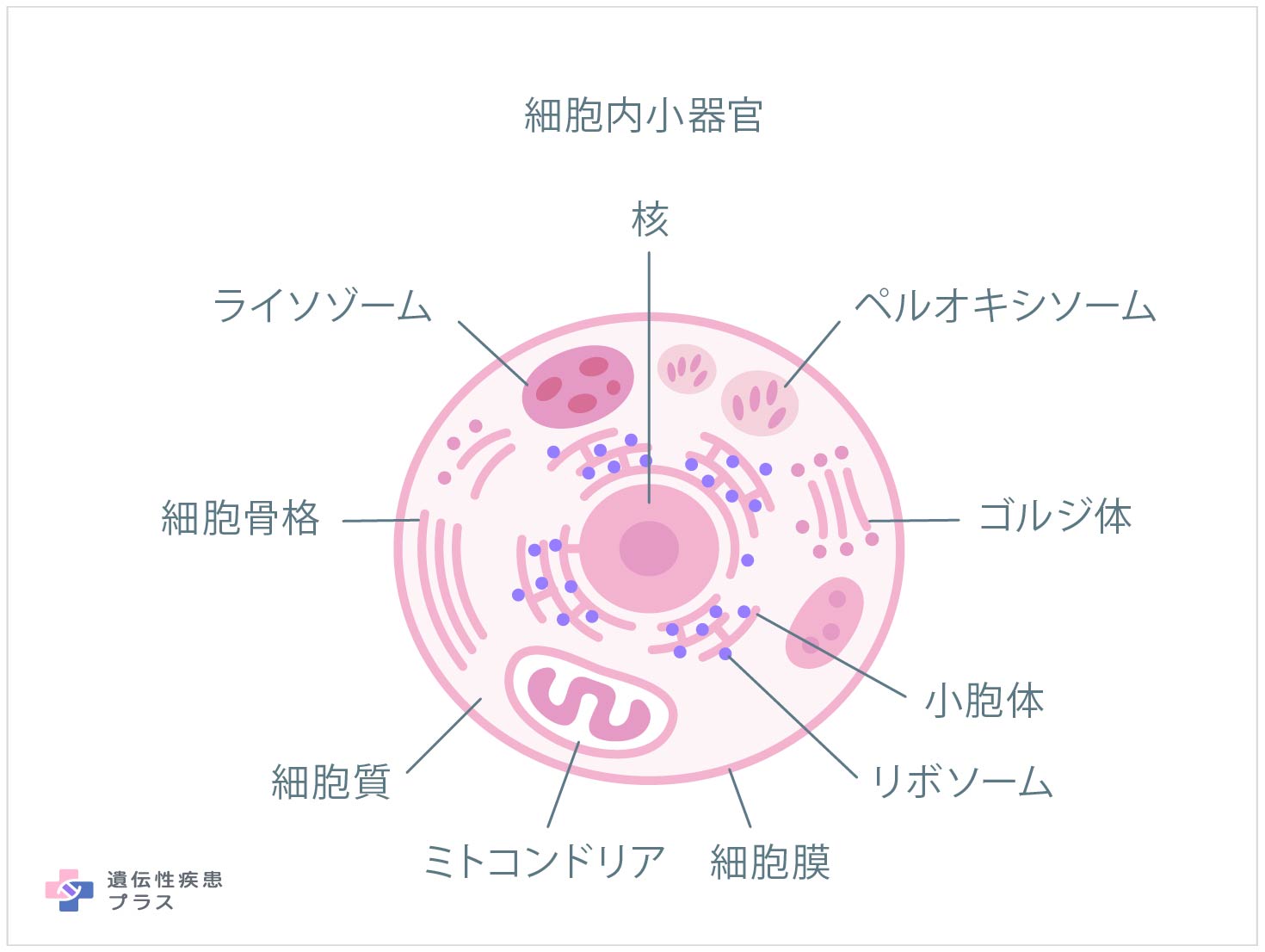
酵素の分解対象となる物質を「基質」と言いますが、約60種のライソゾーム酵素が分解する基質はそれぞれ、不要になったタンパク質、DNA、RNA、多糖類、脂質のいずれかです。こうしたライソゾーム酵素の設計図となる遺伝子(もしくは酵素の働きに影響するタンパク質の設計図となる遺伝子)のどれかに変異があり、正しく機能する酵素が必要なだけ作られなくなると、分解されるべき不要物がそのまま細胞の中に溜まっていきます。それが原因となって発症するのが「ライソゾーム病」です。
ライソゾーム病の症状は、たくさんの種類があるライソゾーム酵素のうち、不具合の起きた酵素によって異なるのですか?
そうですね。ライソゾーム病は、いろいろな名前の付いたライソゾーム酵素異常症の総称ですが、それらの病名と不具合の起きている酵素の種類は、ほぼ1:1の関係にあります。例えば、ゴーシェ病の原因となる酵素はβ-グルコセレブシダーゼ、ファブリー病の原因となる酵素はα-ガラクトシダーゼA、ムコ多糖症Ⅰ型の原因となる酵素はα-L-イズロニダーゼ、といった具合に1:1の関係で、それぞれ症状も異なります。
日本にライソゾーム病の患者さんはどのくらいいるのでしょうか?
令和2年度の医療受給者証所持者数は、ライソゾーム病全体で1,529人でした。平成24年度には911人だったので、増えていますね。これは、治療法が出てきたり、診断法が改善されたりした影響で、きちんとライソゾーム病と診断される人が増えたのだと思います。
ライソゾーム病は、どのような遺伝形式で伝わるのでしょうか?
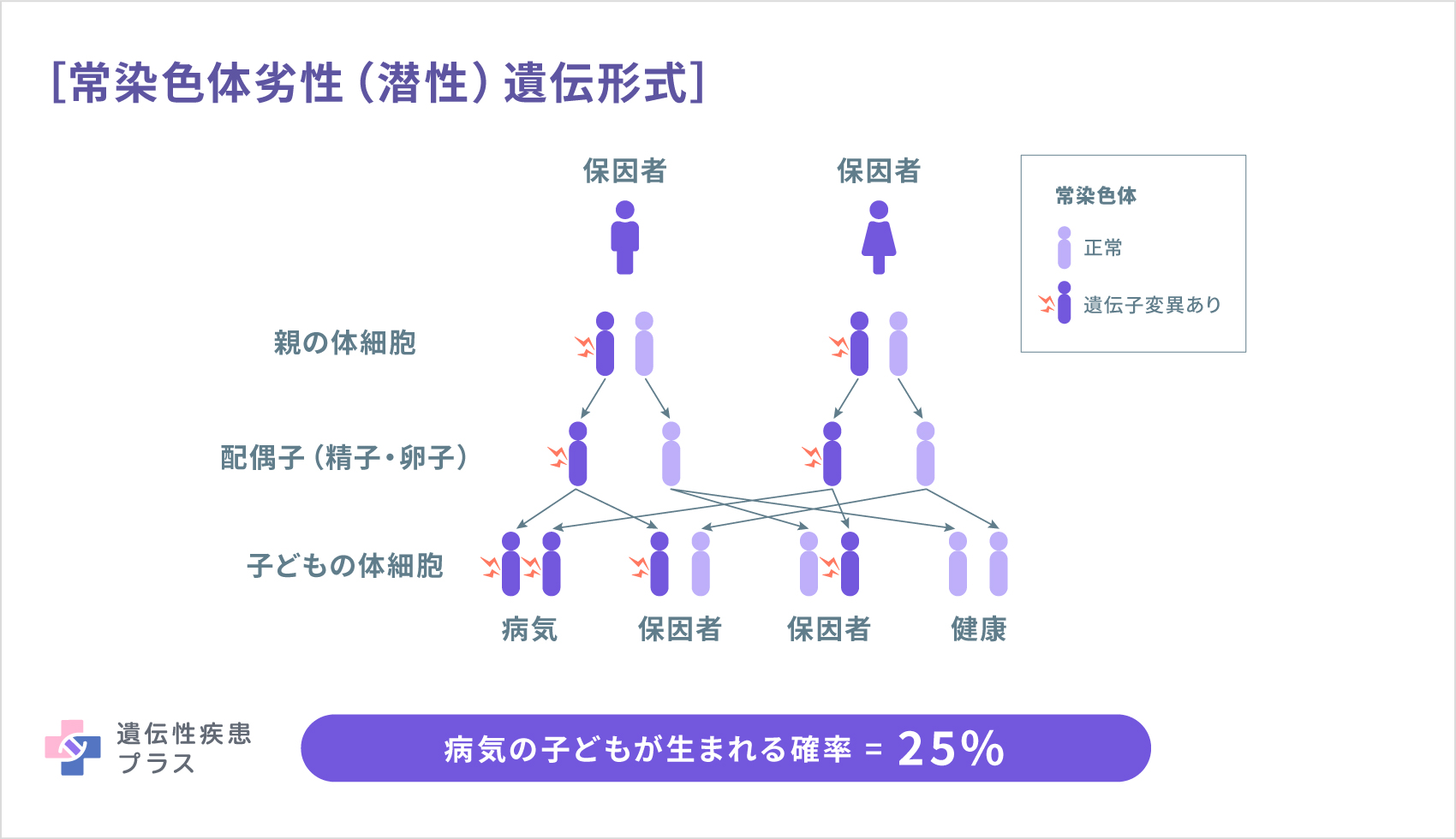
ほとんどのライソゾーム病は、常染色体劣性(潜性)遺伝形式で遺伝します。ヒトが2つ1セットで持っている遺伝子のうち、片方だけに病気の原因となる変異があった場合、その人は病気を発症せず「保因者」となります。両親がそれぞれ保因者だった場合、2つとも病気の原因となる遺伝子を受け継いだ子どもは、ライソゾーム病を発症することになります。この確率は25%です。
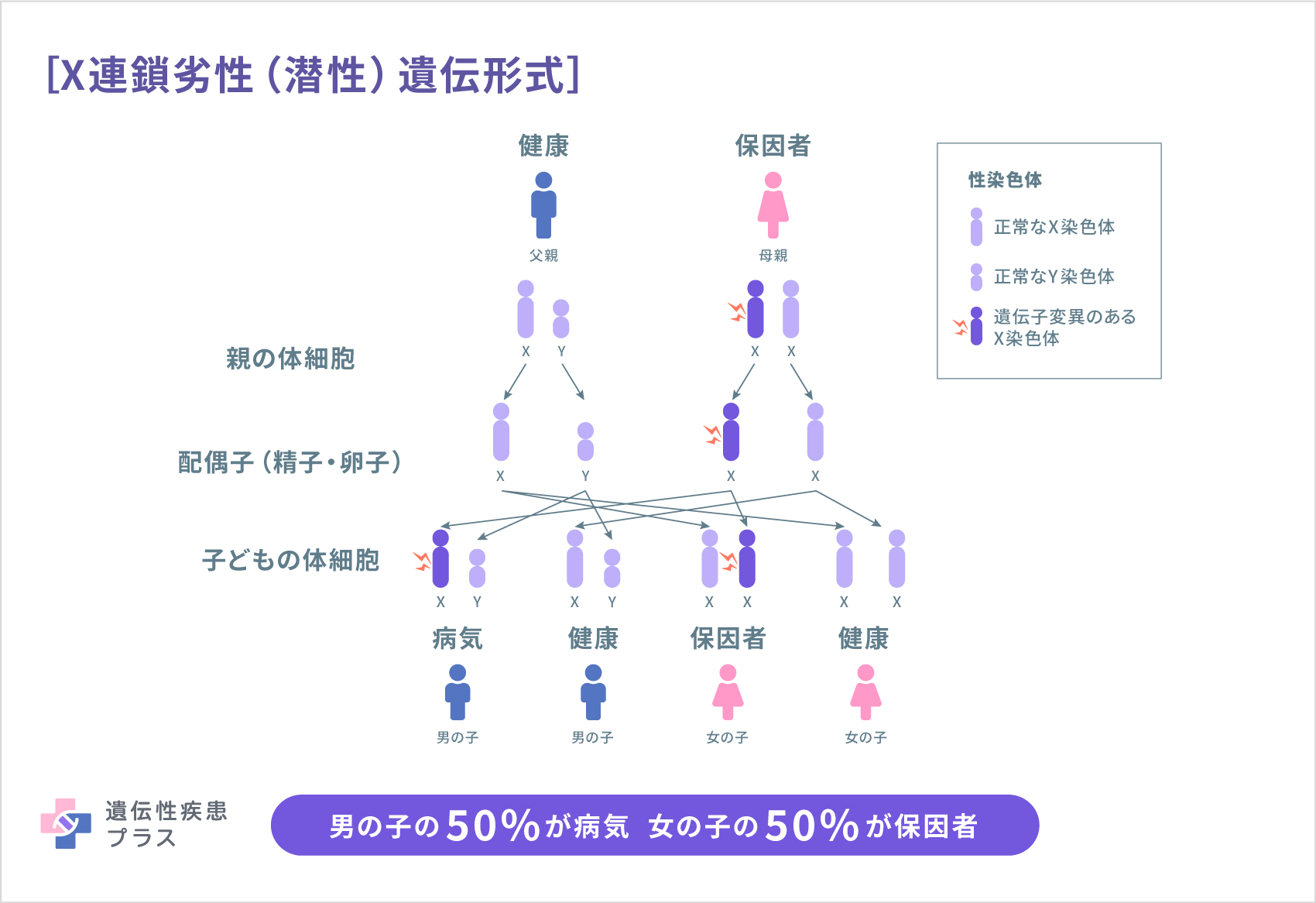
このほか、X染色体連鎖劣性(潜性)遺伝形式で遺伝するライソゾーム病も見つかっています(例:ムコ多糖症II型/ハンター症候群、ファブリー病、ダノン病)。この場合、発症するのはほとんどが男のお子さんとなります。
ライソゾーム病の治療薬には、どのようなものがありますか?
2022年10月現在、約60疾患のライソゾーム病に対して、19の薬剤が国内で承認されています。これらの薬剤は、その作用によって3つの種類に大きく分けられます。1つ目は、「酵素補充療法」として、体の中でうまく働いていない酵素のかわりに、正しく働く酵素を外から補充してあげる薬です。点滴で投与する薬で、ライソゾーム病の治療薬としては最も一般的と言えます。2つ目は、酵素がうまく働かないことで体内に不要物(基質)が溜まってきますが、その基質が溜まるのを遅らせるようにする薬(基質合成抑制薬)です。この薬は飲み薬で、例えばゴーシェ病の治療薬などとして使われています。3つ目は、低分子シャペロン薬と呼ばれる種類の薬で、うまく働けない酵素にくっついて正しく働くように変化させる薬です。この薬も飲み薬で、ファブリー病の治療薬などとして使われています。
一昔前には治療法がなかったライソゾーム病ですが、今や同じ疾患に対して複数の治療法があるものも出てきているような状況になってきました。これはとても喜ばしいことです。また、酵素補充療法は、細胞に取り込まれづらいとか、中枢神経系に取り込まれづらいとか、そういった課題があったのですが、きちんと取り込まれるように改良された薬剤なども出てきています。もちろん、治療薬がまだ開発されていなかったライソゾーム病に対する新たな酵素補充療法も登場してきており、最も新しいところでは、酸性スフィンゴミエリナーゼ欠損症(ASMD)に対する唯一の治療薬として酵素補充療法薬が、2022年6月に、世界で初めて、日本で保険診療として使えるようになったんですよ。
ASMDはどのようなライソゾーム病ですか?
酸性スフィンゴミエリナーゼ欠損症(ASMD)は、ライソゾーム酵素「酸性スフィンゴミエリナーゼ」の設計図となるSMPD1遺伝子に変異があり、この酵素が作られない、または働きが弱いことで発症する病気です。この酵素の基質となる、スフィンゴミエリンという物質が、肝臓や脾臓、肺などに溜まり、さまざまな症状が引き起こされます。常染色体劣性(潜性)遺伝形式で遺伝します。
ASMDにはニーマンピック病(NPD)という別名があり、NPD-A型(内臓神経型ASMD)、NPD-B型(慢性内臓型ASMD)、NPD-A/B型(慢性内臓神経型ASMD)の3つの病型があります。3つの病型のうち、NPD-A型は最も重症で、乳児のうちに発症し、神経症状(けいれんなど)や内臓の症状(肺炎など)が急速に進行して、治療をしなければ3歳までにほとんどの方が命を落とします。NPD-B型は、肝臓や脾臓が腫れたり、肺に異常が現れたりなど、内臓にさまざまな症状が現れますが、神経症状が現れることはまれで、症状はゆっくりと進行します。発症時期は、乳児期から成人期までさまざまで、治療を受けられている成人後期(40~50歳)の方もいます。NPD-A/B型は中間タイプで、小児期から神経症状や内臓症状が現れますが、症状の進行は非常に緩やかです。
病型の違いは、何が原因で生じているのですか?
この病型の違いは、SMPD1遺伝子のどの部分がどのように変異しているかによって生じています。酸性スフィンゴミエリナーゼの通常の酵素活性を100%とすると、変異によって活性が30~20%くらいに落ちたあたりから、症状が出てきます。NPD-A型は酵素活性が5%以下、NPD-B型は10%程度なのですが、この違いは遺伝子の変異の種類によって生じているということになります。
ちなみに、ニーマンピック病C型という病気もあるのですが、これはまったく違う遺伝子の変異で生じている病気で、現在はASMDとは別の病気として区別されています。
日本にASMDの患者さんはどのくらいいらっしゃいますか?
ASMDは、とても珍しい病気で、患者さんの割合は10万人当たり0.4~0.6人と報告されています。日本の人口当たりで計算すると、国内に200~300人の患者さんがいると推定されますが、実際に診断されている患者さんはずっと少ないため、未診断の患者さんもおられるようです。3つの病型の中ではNPD-B型の患者さんが多いことから、症状を持っていても、比較的軽症なため診断されていない方もおられるのではないかと思っています。患者さんの数が少なく、他の病気でもみられる症状が多いことも、なかなか診断がつかない原因かも知れません。検査で酵素の活性を測定すれば、すぐに診断はつきます。
ライソゾーム酵素の検査は、どこの病院でも行ってもらえるのですか?
ライソゾーム酵素の活性を測定できる施設は、国内に数か所しかないので、どこの病院でもすぐにというわけにはいきません。しかし、そうした施設に、日本全国の病院から診断のための測定依頼が行きます。酸性スフィンゴミエリナーゼの活性測定を行っているのは、今のところ私のいる秋田大学と鳥取大学の2か所ですが、全国からの検査依頼を受け入れています。ですので、検査施設は限られていますが、全国どこにいる人も、ライソゾーム病の疑いとなった場合に検査を受けることができる体制は整っています。もしもご自身で、なかなか診断がつかないけれどライソゾーム病の可能性があるのかもと思っている方は、ぜひまずはお近くの病院で精密検査を受けてみてください。積極的に精密検査を受けることが、診断への近道になります。
治療可能なライソゾーム病について、新生児マススクリーニング検査の対象疾患として加わっていく予定はあるのでしょうか?
検討は始まっており、実際いくつかの自治体では、特定のライソゾーム病が項目に組み込まれ始めています。ライソゾーム病はたくさんの種類があるので、どれを対象とするかは、いろいろ議論されているところです。中でも神経症状の強いライソゾーム病に関しては、早く見つけて治療を開始した場合の効果がどのくらい得られるかという辺りが議論のポイントになっています。
技術的には、現在一般的に行われている、生まれた赤ちゃんのかかとから少量の血液をろ紙に採取して、それを乾燥させたもの(乾燥ろ紙血)を使用して各種ライソゾーム病の検査も可能です。
ライソゾーム病について、遺伝子治療の開発は進んでいるのでしょうか?
ライソゾーム酵素の遺伝子を体内に運び込むような遺伝子治療の開発研究が、米国では行われています。酵素補充療法のお薬は、脳などの中枢神経に届けづらいなどの弱点があるのですが、安全性の高い特殊なウイルスに詰め込んだ遺伝子という形で脳に酵素を届けるなどの方法について、検討が進められています。まだ動物実験の段階の、基礎的な研究も含めると、日本も含め、世界的にいろいろな研究が進められています。
ライソゾーム病ではないのですが、脊髄性筋萎縮症という、同じように新生児マススクリーニング検査で早期発見してすぐに治療を開始すれば命が助かる病気について、遺伝子治療が国内で保険診療の対象となっています。お子さんがこの遺伝子治療を受けて元気になっていく様子を、学会で動画として見た時には、すごいなあ、素晴らしいなあと思いました。新しい治療が出るというのは、つくづく素晴らしいことだと思います。ライソゾーム病も、そんな風になっていくと良いなと思っています。
ライソゾーム病の治療に関し、現状での課題点を教えてください
酵素補充療法は、非常に効果的である一方で、先ほども言ったように、中枢神経系に届けづらいという弱点があります。こうしたところが、薬の改良で克服されていけば良いなと思っています。こうした改良は、各国で精力的に進められており、すでに、中枢神経に届ける仕組みをもった薬や、中枢神経に直接注入して治療するような薬も出てきていますので、今後に期待したいと思っています。
最初の方でお話しした3通りの治療法のうち、基質合成抑制薬と低分子シャペロン薬は、まだあまり多くの疾患に適応されていませんが、今後研究が進み、これらも治療の選択肢として登場してくると期待しています。そんな風になってくると、生活の質(QOL)を含め、患者さんにとって非常に良い治療となってくるのではないかと思っています。
神経症状が進んだ状態で診断された患者さんは、治療を開始すれば神経症状の改善が期待できますか?
現在の治療では、進行した神経症状を改善するというのは、なかなか難しい状況です。将来的には、遺伝子治療などに期待したいところですが、一旦進んだ神経症状を戻すのは難しいため、やはり早期発見・早期の治療開始がとても重要だと言えます。
最後に先生から、遺伝性疾患プラス読者の方々へ一言メッセージをお願いします
病気の仕組みの解明や治療法の開発は、日進月歩です。ライソゾーム病に限らず、さまざまな疾患に対して、新しい考え方が提唱され、また、その考え方に基づいた新しい治療法などが次々と開発されてきています。患者さんは、そうした治療を受けてQOLを改善していくことになりますが、そうした中で非常に重要になるのは、患者さんご本人・ご家族含め、関係する病気について「正しく理解する」ことです。治療法がある病気でも、場合によっては効果がはっきりするまで時間がかかり、根気よく治療を受け続ける必要があることもあります。そうした中で、病気の自己管理を続けていく、治療を受けていくうえで、正しい理解は本当に大切です。ぜひ、主治医の先生とよく情報交換をすることで正しい情報を得て、粘り強く病気や治療と向き合って行って頂ければと思います。
約50種類あるライソゾーム酵素のうち、どれかの遺伝子に変異があることで発症する、ライソゾーム病。一昔前には治療法がなかったライソゾーム病も、酵素補充療法をはじめとした3通りの治療法を中心に、徐々に新しい治療法が開発されつつあり、一部の疾患では新生児マススクリーニング検査も開始されているとわかりました。今後、研究が進むことで、全てのライソゾーム病について、早期発見・早期治療開始で治癒に至るようになる日がくることを期待したいです。(遺伝性疾患プラス編集部)







