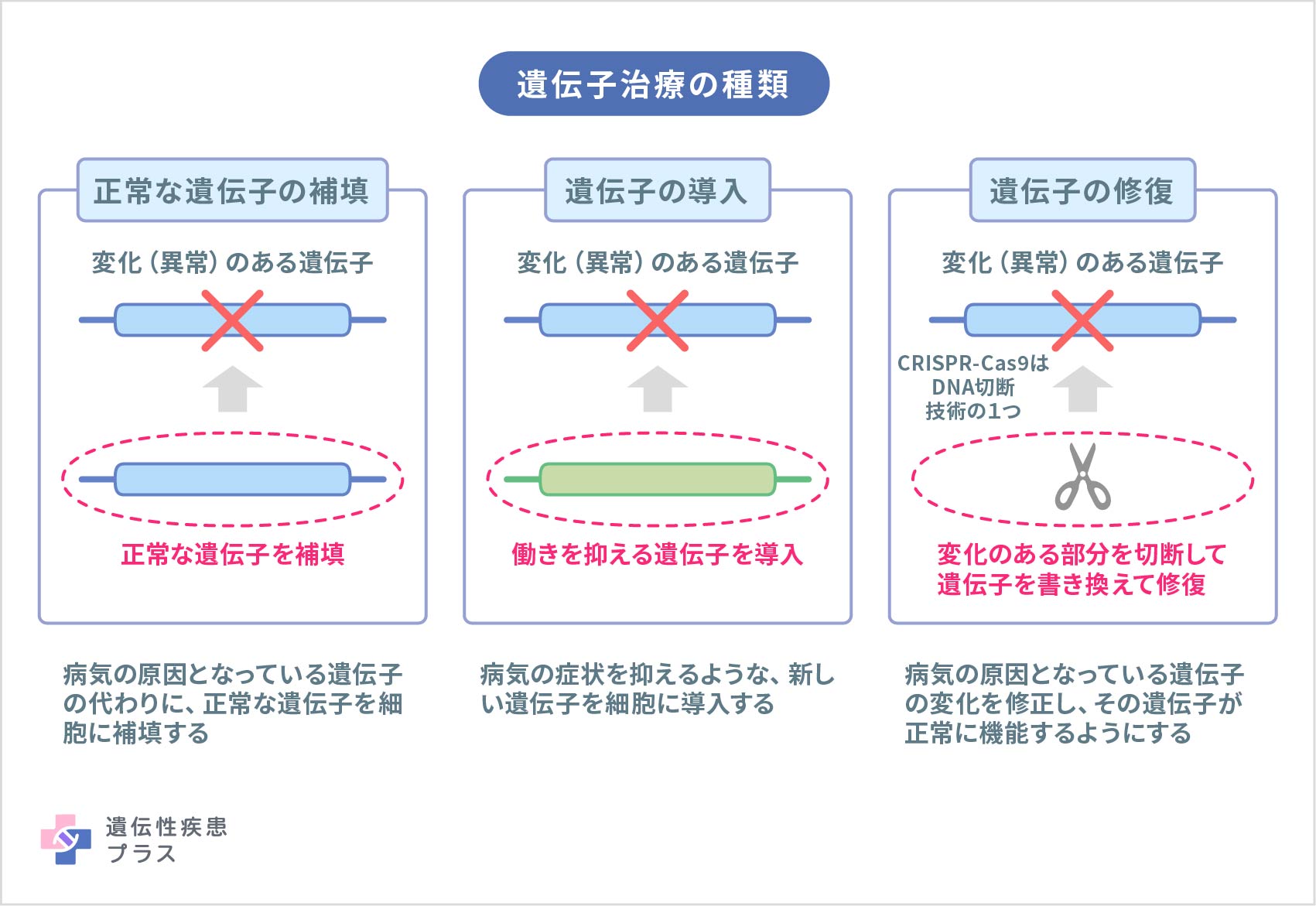
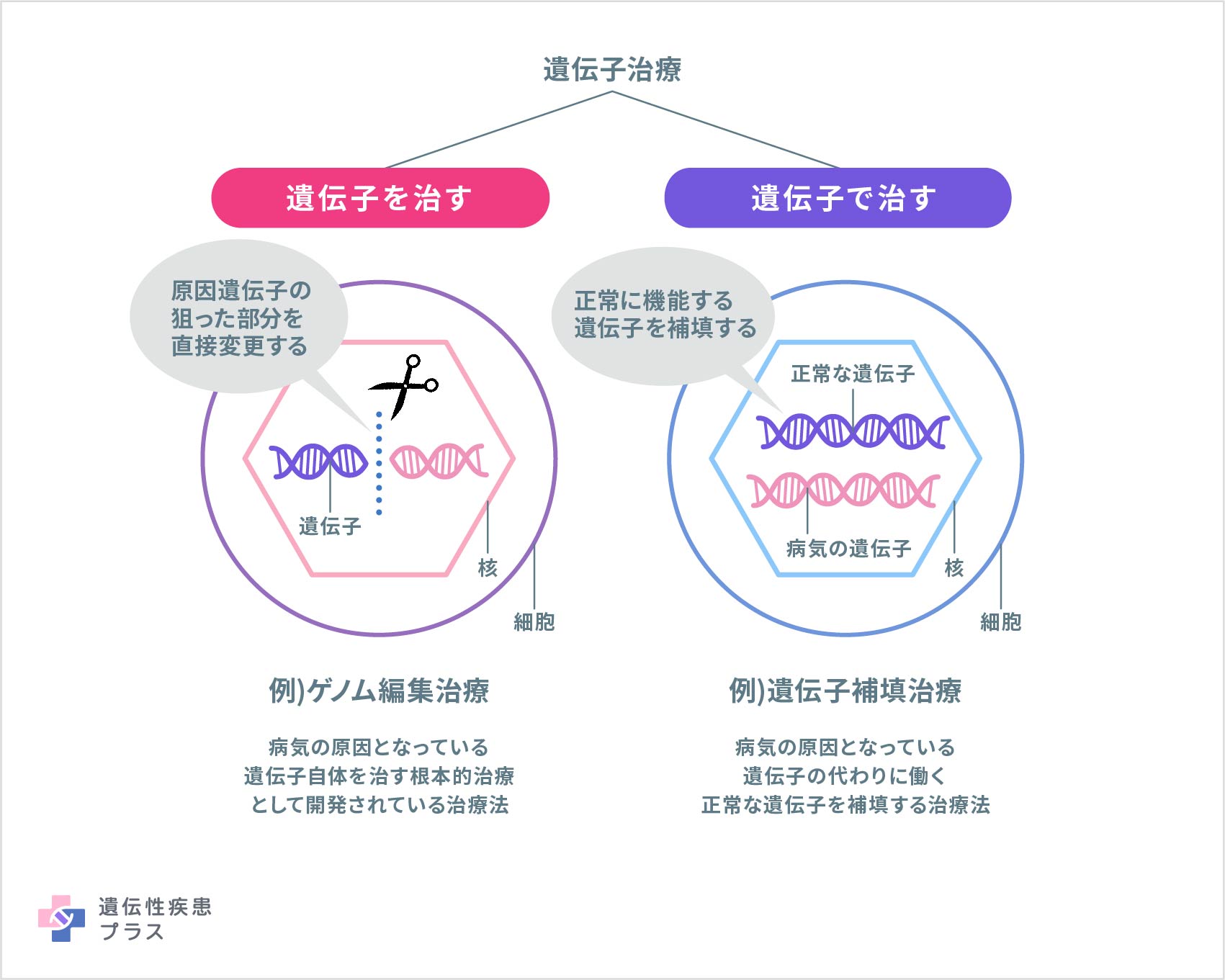
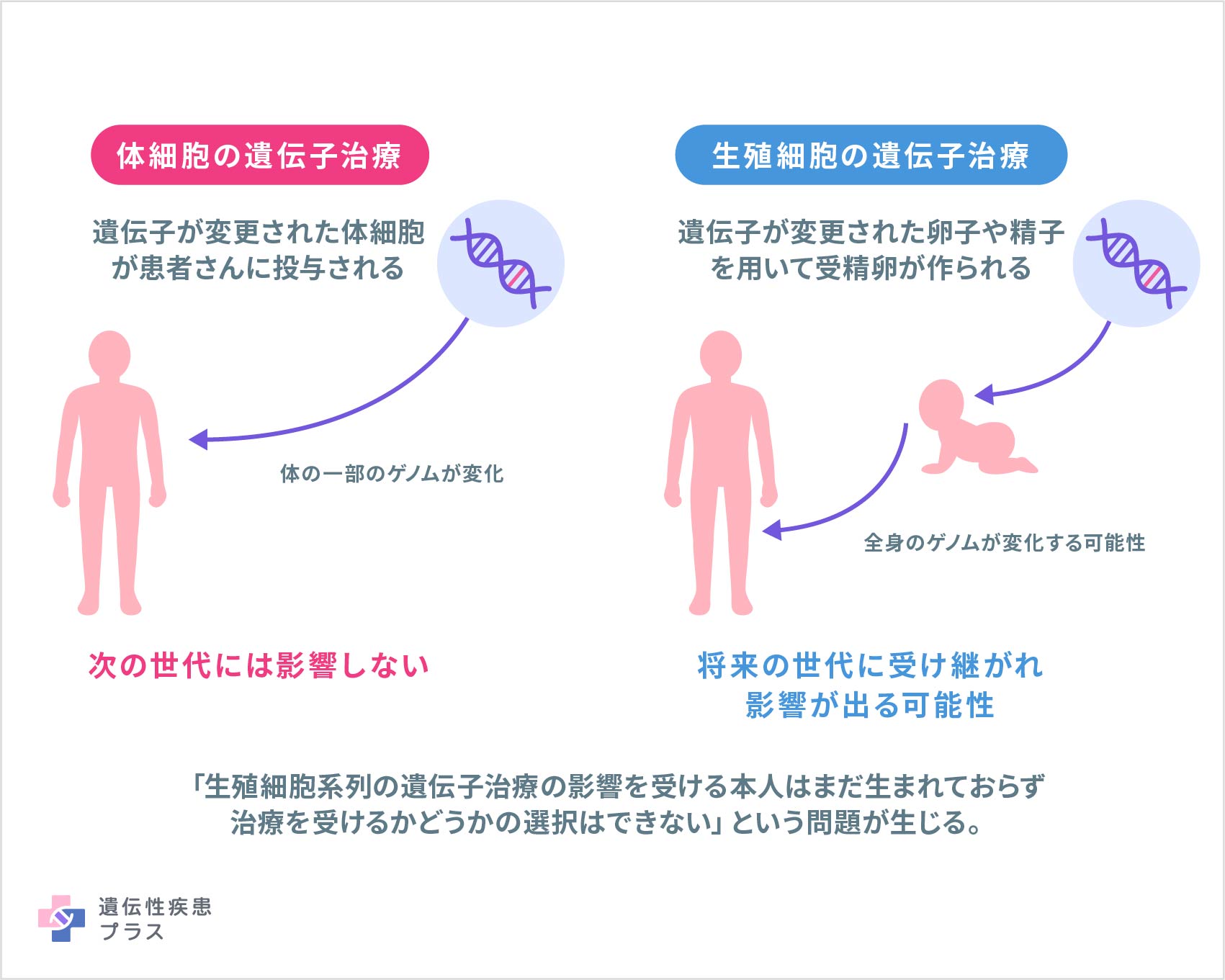
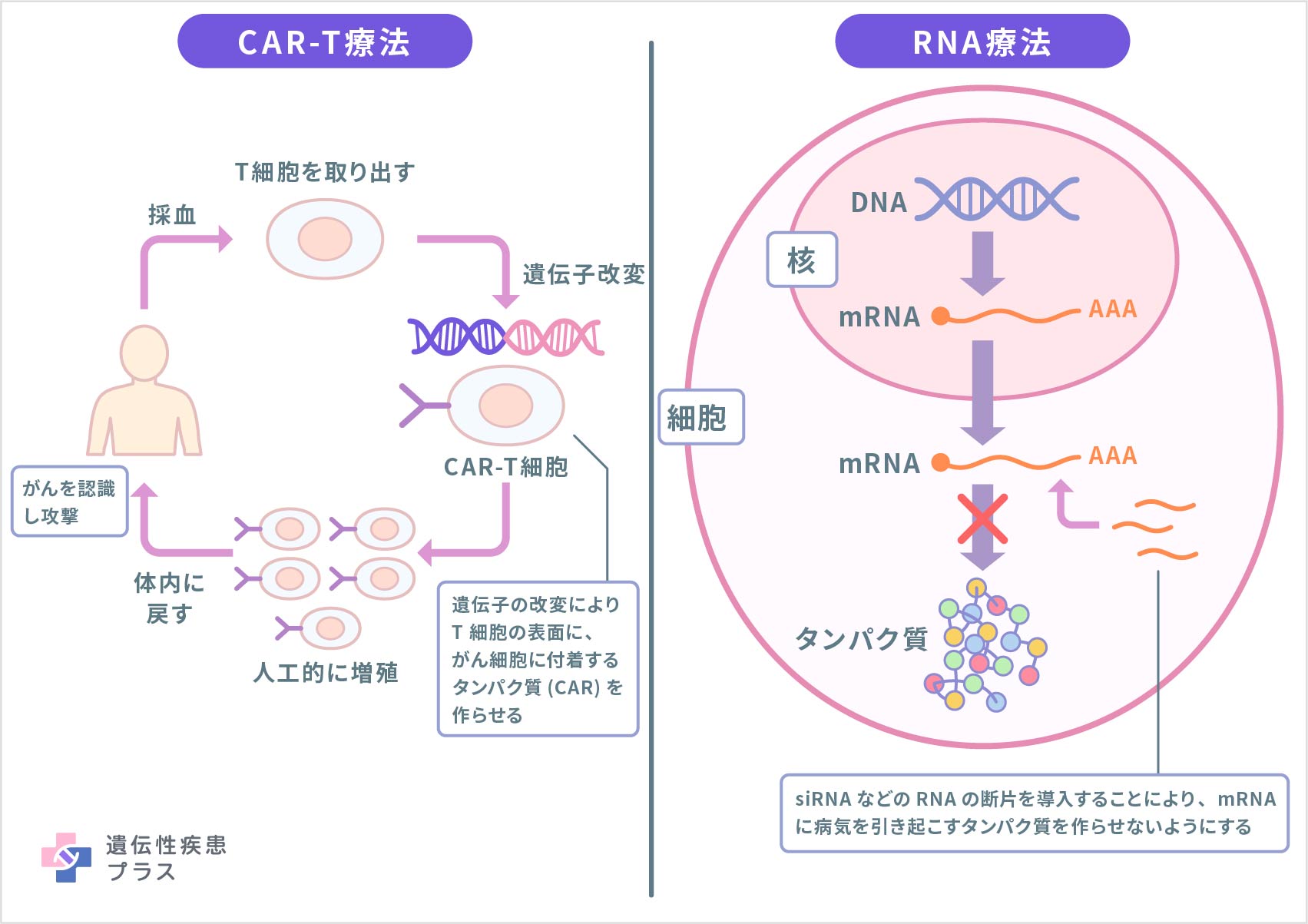
最初の遺伝子治療の臨床試験が行われたのは、30年以上前のことです。初期の研究において、遺伝子治療は深刻な健康被害をもたらす可能性を持つと示されたことがありました。しかしそれ以来、治療メカニズムの研究が進められ、健康被害を引き起こす可能性の低い、より改良された遺伝子治療の研究開発が行われてきました。遺伝子治療は比較的新しい技術のため、予測できないリスクが生じる可能性も考慮しながら、研究者、研究機関、規制当局は、遺伝子治療の研究や臨床試験、承認後の治療ができる限り安全に行われるように努めています。
例えば米国の場合では、以下のようなルールやガイドラインのもとで、新しい遺伝子治療の安全性が確認されています。
臨床試験に参加する人々は、包括的な連邦法、規制、ガイドラインによって保護されます。米国食品医薬品局(FDA)は、米国内の全ての遺伝子治療に関わる製品の規制と研究の監視を行っており、臨床試験を行う場合には、まずFDAの許可を得なければなりません。FDAは、臨床試験の参加者にとって安全ではないと疑われる臨床試験を拒否または中断する権限を持っています。
また、米国国立衛生研究所(NIH)も遺伝子治療研究の安全性を確保するために重要な役割を担っています。NIHは、遺伝子治療を用いた臨床試験を実施する際に、研究者や施設(大学や病院など)が従うべきガイドラインを示しています。NIHから資金援助を受けている施設での臨床試験は、このガイドラインに従い、遺伝子治療に関わる研究に対してNIHのバイオテクノロジー研究活動室に登録する必要があります。その後、各臨床試験の計画書はNIH組換えDNA諮問委員会(RAC)の審査によって、医学的、倫理的、安全性に関する問題があるかどうかが判断された後、RACの公開会議でさらに審議されることになります。
さらに、遺伝子治療の臨床試験を実施するためには、各研究機関において施設内審査委員会(IRB)と施設内バイオセーフティ委員会(IBC)の承認が必要です。IRBは科学的・医学的アドバイザーと消費者からなる委員会で、施設内のすべての研究の審査を行います。IBCは、研究機関内で行われる危険性のある研究を審査し、承認します。このように複数の評価と監視を行うことで、遺伝子治療研究の計画と実施において、安全性が最優先されるようになります。
臨床試験は、3つのフェーズで行われます。第1相試験では、治療が人々にとって安全かどうか、その副作用を特定します。第2相試験では、その治療法が有効かどうか、つまり効果があるかどうかを判断します。第3相試験では、新しい治療法と現在承認されている治療法(標準治療)を比較します。医師は、新しい治療法が標準治療よりも効果が高いか、副作用が少ないかどうかを確認します。そして、FDAは臨床試験の結果を確認し、検討します。新しい治療法の利点が副作用を上回ると判断された場合、その治療法は承認され、医師は治療に使用することができるようになります。

臨床試験の結果により、これまでに脊髄性筋萎縮症(SMA)やレーバー先天性黒内障(海外で承認)などの疾患を治療する治療法など、一部の遺伝子治療法が承認されています。(遺伝性疾患プラス編集部)
関連リンク